את המחקר הובילו חוקרים משתי פקולטות בטכניון ועמיתם מאוניברסיטת טוקיו.
מאמר חדש שהתפרסם ב–Nature Communications מציג פפטידים ייחודיים בעלי פוטנציאל אנטי-סרטני. את המחקר הובילו פרופ' אשרף בריק והפוסט-דוקטורנטים אבשיק סאהא וגנגה ומיסטי מהפקולטה לכימיה ע"ש שוליך יחד עם פרופ' נביה איוב מהפקולטה לביולוגיה בטכניון ופרופ' הירו סוגה מאוניברסיטת טוקיו.
בתמונה מימין לשמאל: פרופ' נביה איוב הפקולטה לביולוגיה בטכניון, פרופ' הירו סוגה מאוניברסיטת טוקיו ופרופ' אשרף בריק מהפקולטה לכימיה ע"ש שוליך.
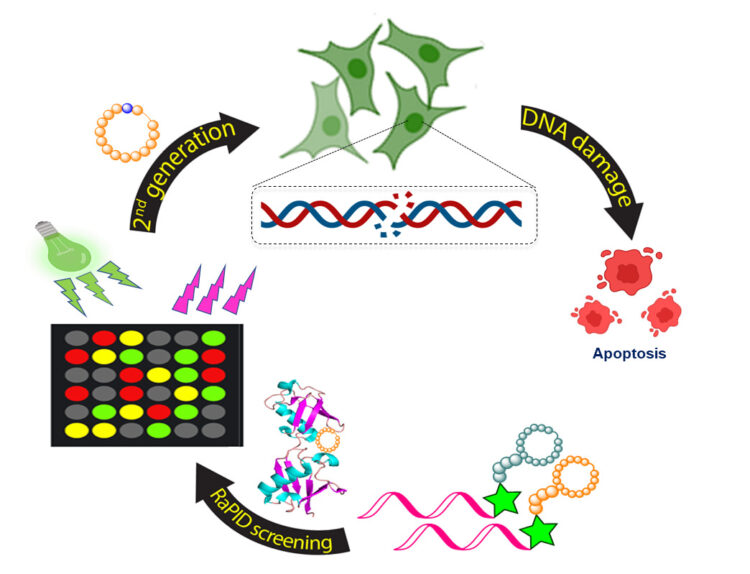
פֶּפְּטִידים הם שרשראות קצרות של חומצות אמינו. בניגוד לחלבונים, המכילים בדרך כלל מאות רבות של חומצות אמינו, פפטידים מכילים לכל היותר עשרות חומצות כאלה. הפפטידים המעגליים שגילו החוקרים נקשרים באופן ספציפי לשרשראות של חלבוני אוביקוויטין – חלבון המשמש בדרך כלל "תג מוות" לחלבונים פגומים. תיוג החלבונים הפגומים מוביל לשיגורם לפירוק בפרוטאזום, פח האשפה של התא. גילויה של מערכת האוביקוויטין הוביל בשנת 2004 להענקת פרס נובל בכימיה לשלושה חוקרים, שניים מהם מהפקולטה לרפואה ע"ש רפפורט בטכניון: פרופ'-מחקר אהרן צ'חנובר ופרופ'-מחקר אברהם הרשקו.
בשנים האחרונות התברר שפעילות מערכת האוביקוויטין תלויה בין השאר בנקודה שבה נקשרות מולקולות האוביקוויטין בשרשרת. לדוגמה, קישור לעמדה 48 (K48) מוביל לסילוק החלבונים לפרוטאזום, ואילו קישור לעמדה 63 (K63) באוביקוויטין מוביל לתיקון DNA פגום.
חוקרי הטכניון פיתחו גישה חדשה להשפעה על מנגנוני האוביקוויטין: במקום התערבות בפעילותם של אנזימים המשפיעים על מנגנונים אלה הם החליטו לנסות להתערב ישירות בשרשרת האוביקוויטין עצמה.
מתוך גישה זו פיתחו החוקרים בעבודה קודמת פפטידים טבעתיים הנקשרים לעמדה 48 בשרשראות האוביקוויטין וכך מונעים ממנה להוביל לפירוק החלבונים הפגומים. שיבוש זה מוביל בהדרגה למות התא כולו. באותו מחקר הם שיערו – ואז הראו – כי כאשר קישור כזה נוצר בגידול סרטני הוא ממית את תאי הסרטן וכך מגן על המטופל. גילוי זה, שפורסם בכתב העת Nature Chemistry בשנת 2019, הוביל להקמתה של חברת סטארטאפ חדשה המקדמת את הגילוי לקראת שימוש קליני.
במחקר הנוכחי יוצרו פפטידים טבעתיים הנקשרים לעמדה 63 באוביקוויטין – העמדה המובילה כאמור לתיקון DNA פגום. החוקרים גילו כי קשירת הפפטידים לעמדה זו משבשת את מנגנון התיקון האמור ומובילה להצטברות של DNA פגום וכך לתמותת תאים. גם כאן, כאשר היקשרות זו מתרחשת בתאי סרטן היא מחסלת תאים אלה. החוקרים מעריכים כי יתכן שאסטרטגיה טיפולית זו תהיה יעילה יותר מתרופות אנטי-סרטניות קיימות הגוררות התפתחות של עמידות נגדן.
פרופ' אשרף בריק הוא ראש הקתדרה ע"ש ג'ורדן ואירן טארק בפקולטה לכימיה ע"ש שוליך. הוא זכה בפרסי הצטיינות רבים ובהם פרס החוקר המצטיין מטעם החברה הישראלית לכימיה ובמענק היוקרתי ERC Advanced Grant.
באיור: בתחילת התהליך נקשרים הפפטידים המעגליים לשרשרת האוביקוויטין; כתוצאה מכך נפגע מנגנון תיקון ה-DNA; ובסופו של דבר עוברים תאי הסרטן תהליך של מוות תאי (אפופטוזיס)
למאמר ב- Nature Communications- לחצו כאן









